トレドミン(ミルナシプラン)は、米国に先んじて日本で承認された数少ない薬のうちの一つです。
うつ病、疼痛などに効果が認められていますが、米国では線維筋痛症に対してのみ承認されています。うつ病に対する適応はありません。
副作用が少なく使いやすい薬ですが、定められた用量ではやや抗うつ効果が弱い印象です。(1日100mgまで、高齢者は60mgまで)
また半減期が短く、1日2回の服用とされているのもマイナスかも知れません。
以下、トレドミン(ミルナシプラン)の特徴を記載します。
セロトニンとノルアドレナリンの再取り込みを阻害するSNRIに分類されます。
線維筋痛症、うつ病、慢性疼痛などに効果が認められています。
ADHD、不安にも恐らく有効であろうと考えられています。
腹圧性尿失禁に対する有効性のデータは不足しています。
本邦で販売されている3つのSNRIのうち、最もバランスの良いセロトニン・ノルアドレナリン取り込み阻害比率を持っています。(サインバルタ、イフェクサー、トレドミン)
セロトニンに対するノルアドレナリン取り込み阻害比率は、トレドミンが1/1.6、サインバルタが1/9、イフェクサーが1/30です。
サインバルタ、イフェクサーに比べて、ノルアドレナリンの再取り込み比率が高く、この点が線維筋痛症や慢性疼痛に効果的に働いていると思われます。
他のSNRIに比べて、発汗や排尿困難の副作用が出やすい可能性があります。ノルアドレナリン取り込み阻害作用が強いことによります。
排尿困難は、女性より男性に多く、若い男性よりも高齢の男性に多く見られます。
トレドミンは活性代謝産物をもちません。
トレドミンは投与された薬剤の大部分がそのまま、または不活性なグルクロノ共役体として尿中に排泄されます。
トレドミンは、チトクロームP450酵素との相互作用がほとんどありません。
トレドミンは性機能障害の副作用を殆ど持たず、性機能はうつ病の他の症状の改善と並行して改善します。
パロキセチンとの比較研究で、全体的な有効性は同程度であったものの、思考力と会話力の低下、集中力の低下、運動能力の低下を示すサブグループでは、トレドミンの方がパロキセチンよりも有意に優れていました。
過量投与の危険性は、比較的少ないと考えられています。
FDA妊娠リスクカテゴリーはCです。
トレドミンの概略
トレドミン(ミルナシプラン)は、フランスのピエール ファーブル(Pierre Fabre)社が1990年代に創製したSNRIです。フランスで1996年12月承認、1997年2月販売開始、日本で1999年9月承認、2000年10月販売開始、米国で2009年1月承認、直近では中国FDAが2010年4月に承認しています。
構造式
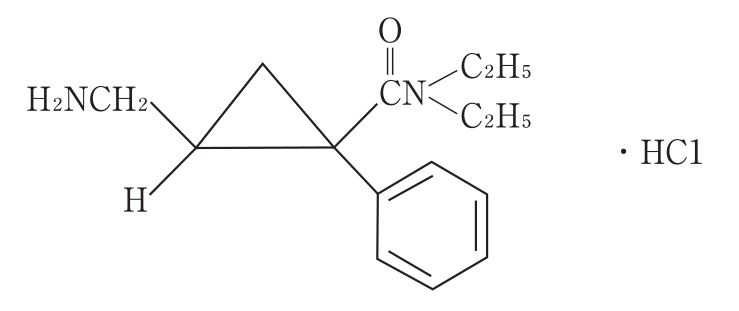
.jpg)
適応(効能又は効果)
うつ病・うつ状態
用法及び用量
初期用量は1 日 25mg、最大1 日 100mg (高齢者は1 日 60mg まで)
1 日 2~3 回に分けて食後に経口投与する。
血中濃度(食後単回投与)
投与約 2~3 時間後にピークに達し
消失半減期(T 1/2 b)は約 8 時間
食事の影響
空腹時投与の血漿中濃度は食後 30 分投与時に比し有意に低い
禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
モノアミン酸化酵素阻害剤を投与中あるいは投与中止後 2 週間以内の患者
尿閉(前立腺疾患等)のある患者
重大な副作用
悪性症候群、セロトニン症候群、痙攣、白血球減少、重篤な皮膚障害、抗利尿ホルモン不適合分泌症候群(SIADH)、肝機能障害、高血圧クリーゼ
副作用(承認時以降平成 17 年 9 月 21 日迄調査 3,771例)
悪心 173例 (4.59%)
傾眠 (眠気) 78例 (2.07%)
排尿困難 70例 (1.86%)
便秘 69例 (1.83%)
頭痛 62例 (1.64%)
浮動性めまい 60例 (1.59%)
食欲不振 51例 (1.35%)
嘔吐 48例 (1.27%)
結合親和性(Ki 値:nM)
SERT 8.5±0.63
NAT 31±1.1
各種神経伝達物質受容体に対してほとんど親和性を示さない